Online first
Bieżący numer
Archiwum
O czasopiśmie
Polityka etyki publikacyjnej
System antyplagiatowy
Instrukcje dla Autorów
Instrukcje dla Recenzentów
Rada Redakcyjna
Komitet Redakcyjny
Recenzenci
Wszyscy recenzenci
2024
2023
2022
2021
2020
2019
2018
2017
2016
Kontakt
Bazy indeksacyjne
Klauzula przetwarzania danych osobowych (RODO)
PRACA PRZEGLĄDOWA
Nieznane oblicze witaminy D3 – modulacja odpowiedzi immunologicznej w wybranych chorobach płuc ze szczególnym uwzględnieniem włóknienia płuc
1
Zakład Biologii Medycznej, Instytut Medycyny Wsi im. W. Chodźki, Lublin, Polska
Autor do korespondencji
Marta Kinga Lemieszek
Zakład Biologii Medycznej, Instytut Medycyny Wsi im. W. Chodźki, Jaczewskiego 2, 20-090, Lublin, Polska
Zakład Biologii Medycznej, Instytut Medycyny Wsi im. W. Chodźki, Jaczewskiego 2, 20-090, Lublin, Polska
Med Og Nauk Zdr. 2024;30(4):259-270
SŁOWA KLUCZOWE
DZIEDZINY
STRESZCZENIE
Wprowadzenie i cel:
Globalny niedobór witaminy D3 ujawnił kluczową rolę tej substancji w patogenezie wielu chorób, w tym chorób płuc, w przebiegu których dochodzi do włóknienia. Jednocześnie pojawiły się doniesienia, że dzięki zdolności do modulacji odpowiedzi immunologicznej witamina D3 może stanowić remedium na wspomniane schorzenia. Celem publikacji był przegląd wyników przeprowadzonych w tym zakresie badań.
Metody przeglądu:
W artykule przedstawiono aktualny stan wiedzy na temat wpływu witaminy D3 na odpowiedź immunologiczną w wybranych chorobach płuc, tj. POChP, IPF, AZPP i astmie alergicznej. Przegląd obejmuje prace oryginalne, dostępne w bazach PubMed i Google Scholar.
Opis stanu wiedzy:
Analiza danych z wykorzystaniem modeli POChP potwierdziła, że niedobór witaminy D3 nasila objawy choroby, natomiast suplementacja jej metabolitami ma korzystny wpływ na jej przebieg, zwłaszcza na proces włóknienia, dzięki wyciszaniu nadmiernej odpowiedzi zapalnej. Witamina D3 zmniejszała również stan zapalny i związany z nim proces włóknienia płuc w przebiegu IPF poprzez obniżenie poziomu cytokin prozapalnych oraz hamowanie przekazywania sygnałów w szlakach zależnych od TGF-β. Korzystny wpływ kalcytriolu (bioaktywna forma witaminy D3) na rozwój astmy alergicznej wynikał z ograniczenia napływu eozynofili oraz redukcji poziomu cytokin prozapalnych przy jednoczesnym zwiększeniu poziomu cytokin przeciwzapalnych. Unikatowe wyniki oceny wpływu witaminy D3 na przebieg AZPP wykazały, że metabolity witaminy D3 hamują rozwój włóknienia płuc poprzez przywracanie równowagi immunologicznej oraz zmniejszenie produkcji czynników prozapalnych i prozwłóknieniowych.
Podsumowanie:
Przedstawiony przegląd badań wskazuje na immunomodulacyjną rolę witaminy D3 w patogenezie POChP, IPF, astmy alergicznej i AZPP oraz na możliwości jej zastosowania w prewencji włóknienia płuc.
Globalny niedobór witaminy D3 ujawnił kluczową rolę tej substancji w patogenezie wielu chorób, w tym chorób płuc, w przebiegu których dochodzi do włóknienia. Jednocześnie pojawiły się doniesienia, że dzięki zdolności do modulacji odpowiedzi immunologicznej witamina D3 może stanowić remedium na wspomniane schorzenia. Celem publikacji był przegląd wyników przeprowadzonych w tym zakresie badań.
Metody przeglądu:
W artykule przedstawiono aktualny stan wiedzy na temat wpływu witaminy D3 na odpowiedź immunologiczną w wybranych chorobach płuc, tj. POChP, IPF, AZPP i astmie alergicznej. Przegląd obejmuje prace oryginalne, dostępne w bazach PubMed i Google Scholar.
Opis stanu wiedzy:
Analiza danych z wykorzystaniem modeli POChP potwierdziła, że niedobór witaminy D3 nasila objawy choroby, natomiast suplementacja jej metabolitami ma korzystny wpływ na jej przebieg, zwłaszcza na proces włóknienia, dzięki wyciszaniu nadmiernej odpowiedzi zapalnej. Witamina D3 zmniejszała również stan zapalny i związany z nim proces włóknienia płuc w przebiegu IPF poprzez obniżenie poziomu cytokin prozapalnych oraz hamowanie przekazywania sygnałów w szlakach zależnych od TGF-β. Korzystny wpływ kalcytriolu (bioaktywna forma witaminy D3) na rozwój astmy alergicznej wynikał z ograniczenia napływu eozynofili oraz redukcji poziomu cytokin prozapalnych przy jednoczesnym zwiększeniu poziomu cytokin przeciwzapalnych. Unikatowe wyniki oceny wpływu witaminy D3 na przebieg AZPP wykazały, że metabolity witaminy D3 hamują rozwój włóknienia płuc poprzez przywracanie równowagi immunologicznej oraz zmniejszenie produkcji czynników prozapalnych i prozwłóknieniowych.
Podsumowanie:
Przedstawiony przegląd badań wskazuje na immunomodulacyjną rolę witaminy D3 w patogenezie POChP, IPF, astmy alergicznej i AZPP oraz na możliwości jej zastosowania w prewencji włóknienia płuc.
Introduction and objective:
The global pandemic of vitamin D3 deficiency has revealed the key role of this substance in the pathogenesis of many conditions, including fibrotic lung diseases. At the same time, emerging reports suggest that vitamin D3, through its ability to modulate the immune response, may offer a remedy for such conditions. The aim of this article is to review the results of the above-mentioned studies.
Review methods:
This article presents the current state of knowledge on the effect of vitamin D3 on immune response in selected lung diseases, i.e. COPD, IPF, HP, and allergic asthma. The review includes original articles available in PubMed and Google Scholar databases.
Brief description of the state of knowledge:
Data analysis from COPD models confirmed that vitamin D3 deficiency exacerbates disease symptoms, while supplementation with its metabolites has a beneficial effect on disease progression, particularly on fibrosis, by mitigating the excessive inflammatory responses. Vitamin D3 also reduces inflammation and the associated lung fibrosis in IPF by lowering levels of pro-inflammatory cytokines and inhibiting TGF-β-dependent signaling pathways. The beneficial effect of calcitriol (bioactive form of vitamin D3) on the development of allergic asthma was due to reduced eosinophil infiltration, reduced pro-inflammatory cytokine levels, and increased anti-inflammatory cytokine levels. The unique findings on the effect of vitamin D3 on the course of HP showed that vitamin D3 metabolites inhibit the development of pulmonary fibrosis by restoring immune balance and reducing the production of pro-inflammatory and pro-fibrotic factors.
Summary:
The presented reviewed of research demonstrates the immunomodulatory role of vitamin D3 in the pathogenesis of COPD, IPF, HP, and allergic asthma, highlighting its potential in the prevention of pulmonary fibrosis.
The global pandemic of vitamin D3 deficiency has revealed the key role of this substance in the pathogenesis of many conditions, including fibrotic lung diseases. At the same time, emerging reports suggest that vitamin D3, through its ability to modulate the immune response, may offer a remedy for such conditions. The aim of this article is to review the results of the above-mentioned studies.
Review methods:
This article presents the current state of knowledge on the effect of vitamin D3 on immune response in selected lung diseases, i.e. COPD, IPF, HP, and allergic asthma. The review includes original articles available in PubMed and Google Scholar databases.
Brief description of the state of knowledge:
Data analysis from COPD models confirmed that vitamin D3 deficiency exacerbates disease symptoms, while supplementation with its metabolites has a beneficial effect on disease progression, particularly on fibrosis, by mitigating the excessive inflammatory responses. Vitamin D3 also reduces inflammation and the associated lung fibrosis in IPF by lowering levels of pro-inflammatory cytokines and inhibiting TGF-β-dependent signaling pathways. The beneficial effect of calcitriol (bioactive form of vitamin D3) on the development of allergic asthma was due to reduced eosinophil infiltration, reduced pro-inflammatory cytokine levels, and increased anti-inflammatory cytokine levels. The unique findings on the effect of vitamin D3 on the course of HP showed that vitamin D3 metabolites inhibit the development of pulmonary fibrosis by restoring immune balance and reducing the production of pro-inflammatory and pro-fibrotic factors.
Summary:
The presented reviewed of research demonstrates the immunomodulatory role of vitamin D3 in the pathogenesis of COPD, IPF, HP, and allergic asthma, highlighting its potential in the prevention of pulmonary fibrosis.
SKRÓTY
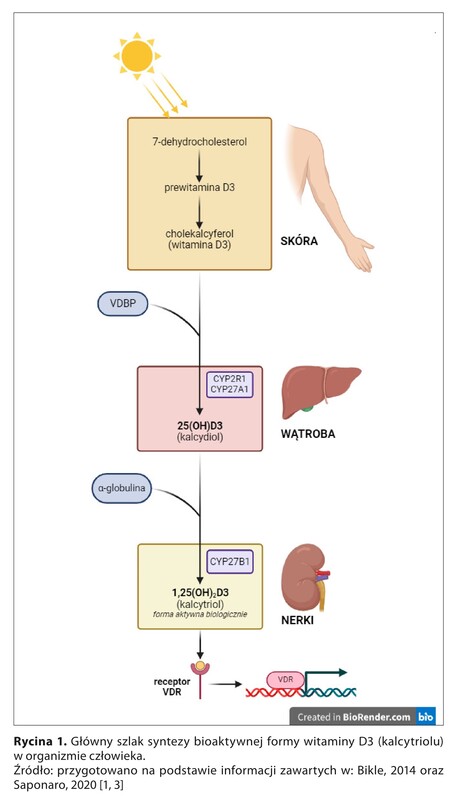
AZPP – alergiczne zapalenie pęcherzyków płucnych; BALF – płyn z płukania oskrzelowo-pęcherzykowego (ang. bronchoalveolar lavage fluid); CYP2R1 – cytochrom P450 2R1; CYP27A1 – cytochrom P450 27A1 (7-hydroksylaza sterolowa); CYP27B1 – cytochrom P450 27B1 (1-α-hydroksylaza); c-Fos – kinaza białkowa zaliczana do protoonkogenów; c-Jun – kinaza białkowa zaliczana do protoonkogenów; CCL – ang. C-C motif chemokine ligand; CRP – białko C-reaktywne (ang. C-reactive protein); CXCL – ang. C-X-C motif chemokine ligand; EMT – przejście epitelialno-mezenchymalne (ang. epithelial-mesenchymal transition); ERK – ang. extracellular signal-regulated kinases; GM-CSF – czynnik stymulujący tworzenie kolonii granulocytów i makrofagów (ang. granulocyte-macrophage colony-stimulating factor); IFN-γ – interferon γ; IL – interleukina; IP – ang. interferon gamma-induced protein; IPF – idiopatyczne włóknienie płuc (ang. idiopathic pulmonary fibrosis); LPS – lipopolisacharyd; MAPK – kinazy aktywowane mitogenami (ang. mitogen-activated protein kinases); MCP – białko chemotaktyczne monocytów (ang. monocyte chemoattractant protein); MHC – główny układ zgodności tkankowej (ang. major histocompatibility complex); MIP – białko zapalne makrofagów (ang. macrophage inflammatory protein); MMP – metaloproteinaza macierzy zewnątrzkomórkowej (ang. matrix metalloproteinase); NF-κB – jądrowy czynnik transkrypcyjny κB (ang. nuclear factor kappa B); P38 – kinaza białkowa aktywowana mitogenem; POChP – przewlekła obturacyjna choroba płuc; RANKL – ligand aktywatora receptora jądrowego czynnika κB (ang. receptor activator for nuclear factor κB ligand); TGF-β – transformujący czynnik wzrostu β (ang. transforming growth factor β); TIMP – tkankowy inhibitor metaloproteinazy (ang. tissue inhibitor of metalloproteinase); TNF-α – czynnik martwicy nowotworów α (ang. tumor necrosis factor α); VDBP – białko wiążące witaminę D (ang. vitamin D binding protein); VDR – receptor dla witaminy D (ang. vitamin D receptor)
Wilczyńska A, Lemieszek MK. Nieznane oblicze witaminy D3 – modulacja odpowiedzi immunologicznej w wybranych chorobach płuc ze szczególnym uwzględnieniem włóknienia płuc. Med Og Nauk Zdr. 2024; 30(4): 259–270. doi: 10.26444/monz/199266
REFERENCJE (56)
1.
Bikle DD. Vitamin D metabolism, mechanism of action, and clinical applications. Chem Biol. 2014;21(3):319–329. https://doi.org/10.1016/j.chem....
2.
Bikle DD. Vitamin D: Production, Metabolism and Mechanisms of Action. 2000. http://www.ncbi.nlm.nih.gov/pu....
3.
Saponaro F, Saba A, Zucchi R. An Update on Vitamin D Metabolism. Int J Mol Sci. 2020;21(18):6573. Published 2020 Sep 8. https://doi.org/10.3390/ijms21....
4.
Sassi F, Tamone C, D’Amelio P. Vitamin D: Nutrient, Hormone, and Immunomodulator. Nutrients. 2018;10(11):1656. https://doi.org/10.3390/nu1011....
5.
Adams JS, Hewison M. Extrarenal expression of the 25-hydroxyvitamin D-1-hydroxylase. Arch Biochem Biophys. 2012;523(1):95–102. https://doi.org/10.1016/j.abb.....
6.
Christakos S, Dhawan P, Verstuyf A, et al. Vitamin D: Metabolism, Molecular Mechanism of Action, and Pleiotropic Effects. Physiol Rev. 2016;96(1):365–408. https://doi.org/10.1152/physre....
7.
Sutton AL, MacDonald PN. Vitamin D: more than a “bone-a-fide” hormone. Mol Endocrinol. 2003;17(5):777–791. https://doi.org/10.1210/me.200....
8.
Pike JW, Meyer MB, Lee SM, et al. The vitamin D receptor: contemporary genomic approaches reveal new basic and translational insights. J Clin Invest. 2017;127(4):1146–1154. https://doi.org/10.1172/JCI888....
9.
Zmijewski MA, Carlberg C. Vitamin D receptor(s): In the nucleus but also at membranes?. Exp Dermatol. 2020;29(9):876–884. https://doi.org/10.1111/exd.14....
10.
Chun RF, Liu PT, Modlin RL, et al. Impact of vitamin D on immune function: lessons learned from genome-wide analysis. Front Physiol. 2014;5:151. Published 2014 Apr 21. https://doi.org/10.3389/fphys.....
11.
Charoenngam N, Holick MF. Immunologic Effects of Vitamin D on Human Health and Disease. Nutrients. 2020;12(7). https://doi.org/10.3390/nu1207....
12.
Anand SP, Selvaraj P. Effect of 1, 25 dihydroxyvitamin D(3) on matrix metalloproteinases MMP-7, MMP-9 and the inhibitor TIMP-1 in pulmonary tuberculosis. Clin Immunol. 2009;133(1):126–131. https://doi.org/10.1016/j.clim....
13.
L Bishop E, Ismailova A, Dimeloe S, Vitamin D and Immune Regulation: Antibacterial, Antiviral, Anti-Inflammatory. JBMR Plus. 2020;5(1):e10405. Published 2020 Sep 15. https://doi.org/10.1002/jbm4.1....
14.
White JH. Emerging Roles of Vitamin D-Induced Antimicrobial Peptides in Antiviral Innate Immunity. Nutrients. 2022;14(2):284. Published 2022 Jan 11. https://doi.org/10.3390/nu1402....
15.
Borel P, Caillaud D, Cano NJ. Vitamin D bioavailability: state of the art. Crit Rev Food Sci Nutr. 2015;55(9):1193–1205. https://doi.org/10.1080/104083....
16.
Pfotenhauer KM, Shubrook JH. Vitamin D Deficiency, Its Role in Health and Disease, and Current Supplementation Recommendations. J Am Osteopath Assoc. 2017;117(5):301–305. https://doi.org/10.7556/jaoa.2....
17.
Holick MF. The vitamin D deficiency pandemic: Approaches for diagnosis, treatment and prevention. Rev Endocr Metab Disord. 2017;18(2):153–165. https://doi.org/10.1007/s11154....
18.
Pierzchała W, Niżankowska-Mogilnicka E, Mejza F. Przewlekła obturacyjna choroba płuc (POChP). In: Szczeklik A, Gajewski P, editors. Interna Szczeklika 2022. Medycyna Praktyczna; 2022.
19.
Chronic obstructive pulmonary disorder (COPD). https://www.who.int/news-room/...) (access: 2024.10.08).
20.
Guo P, Li R, Piao TH, et al. Pathological Mechanism and Targeted Drugs of COPD. Int J Chron Obstruct Pulmon Dis. 2022;17:1565–1575. https://doi.org/10.2147/COPD.S....
21.
Liu T, Zhang L, Joo D, et al. NF-κB signaling in inflammation. Signal Transduct Target Ther. 2017;2:17023. https://doi.org/10.1038/sigtra....
22.
Barnes PJ. Inflammatory mechanisms in patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol. 2016;138(1):16–27. https://doi.org/10.1016/j.jaci....
23.
Wang Y, Xu J, Meng Y, et al. Role of inflammatory cells in airway remodeling in COPD. Int J Chron Obstruct Pulmon Dis. 2018;13:3341–3348. https://doi.org/10.2147/COPD.S....
24.
Agraval H, Kandhari K, Yadav UCS. MMPs as potential molecular targets in epithelial-to-mesenchymal transition driven COPD progression. Life Sci. 2024;352:122874. https://doi.org/10.1016/j.lfs.....
25.
Ishii M, Yamaguchi Y, Isumi K, et al. Transgenic Mice Overexpressing Vitamin D Receptor (VDR) Show Anti-Inflammatory Effects in Lung Tissues. Inflammation. 2017;40(6):2012–2019. https://doi.org/10.1007/s10753....
26.
Heulens N, Korf H, Cielen N, et al. Vitamin D deficiency exacerbates COPD-like characteristics in the lungs of cigarette smoke-exposed mice. Respir Res. 2015;16(1):110. https://doi.org/10.1186/s12931....
27.
Fu L, Fei J, Tan Z-X, et al. Low Vitamin D Status Is Associated with Inflammation in Patients with Chronic Obstructive Pulmonary Disease. J Immunol. 2021;206(3):515–523. https://doi.org/10.4049/jimmun....
28.
Jorde I, Stegemann-Koniszewski S, Papra K, et al. Association of serum vitamin D levels with disease severity, systemic inflammation, prior lung function loss and exacerbations in a cohort of patients with chronic obstructive pulmonary disease (COPD). J Thorac Dis. 2021;13(6):3597–3609. https://doi.org/10.21037/jtd-2....
29.
Dastan F, Salamzadeh J, Pourrashid MH, et al. Effects of High-Dose Vitamin D Replacement on the Serum Levels of Systemic Inflammatory Biomarkers in Patients with Acute Exacerbation of Chronic Obstructive Pulmonary Disease. COPD. 2019;16(3–4):278–283. https://doi.org/10.1080/154125....
30.
Rafiq R, Aleva FE, Schrumpf JA, et al. Vitamin D supplementation in chronic obstructive pulmonary disease patients with low serum vitamin D: a randomized controlled trial. Am J Clin Nutr. 2022;116(2):491–499. https://doi.org/10.1093/ajcn/n....
31.
Han J, Cheng C, Zhu Z, et al. Vitamin D reduces the serum levels of inflammatory cytokines in rat models of periodontitis and chronic obstructive pulmonary disease. J Oral Sci. 2019;61(1):53–60. https://doi.org/10.2334/josnus....
32.
Mei Q, Liu Z, Zuo H, et al. Idiopathic Pulmonary Fibrosis: An Update on Pathogenesis. Front Pharmacol. 2021;12:797292. https://doi.org/10.3389/fphar.....
33.
Heukels P, Moor CC, von der Thüsen JH, et al. Inflammation and immunity in IPF pathogenesis and treatment. Respir Med. 2019;147:79–91. https://doi.org/10.1016/j.rmed....
34.
Kolahian S, Fernandez IE, Eickelberg O, et al. Immune Mechanisms in Pulmonary Fibrosis. Am J Respir Cell Mol Biol. 2016;55(3):309–322. https://doi.org/10.1165/rcmb.2....
35.
Lo Re S, Dumoutier L, Couillin I, et al. IL-17A-producing gammadelta T and Th17 lymphocytes mediate lung inflammation but not fibrosis in experimental silicosis. J Immunol. 2010;184(11):6367–6377. https://doi.org/10.4049/jimmun....
36.
Hou Z, Ye Q, Qiu M, et al. Increased activated regulatory T cells proportion correlate with the severity of idiopathic pulmonary fibrosis. Respir Res. 2017; 18(1): 170. https://doi.org/10.1186/s12931....
37.
Boveda-Ruiz D, D’Alessandro-Gabazza CN, Toda M, et al. Differential role of regulatory T cells in early and late stages of pulmonary fibrosis. Immunobiology. 2013;218(2):245–254. https://doi.org/10.1016/j.imbi....
38.
Zhang Z, Yu X, Fang X, et al. Preventive effects of vitamin D treatment on bleomycin-induced pulmonary fibrosis. Sci Rep. 2015;5:17638. https://doi.org/10.1038/srep17....
39.
Tan Z-X, Chen Y-H, Xu S, et al. Calcitriol inhibits bleomycin-induced early pulmonary inflammatory response and epithelial-mesenchymal transition in mice. Toxicol Lett. 2016;240(1):161–171. https://doi.org/10.1016/j.toxl....
40.
Zhu W, Ding Q, Wang L, et al. Vitamin D3 alleviates pulmonary fibrosis by regulating the MAPK pathway via targeting PSAT1 expression in vivo and in vitro. Int Immunopharmacol. 2021;101(Pt B):108212. https://doi.org/10.1016/j.inti....
41.
Schapochnik A, da Silva MR, Leal MP, et al. Vitamin D treatment abrogates the inflammatory response in paraquat-induced lung fibrosis. Toxicol Appl Pharmacol. 2018;355:60–67. https://doi.org/10.1016/j.taap....
42.
Yavari M, Mousavi SAJ, Janani L, et al. Effects of supplementation of vitamins D, C and E on Idiopathic Pulmonary Fibrosis (IPF): A clinical trial. Clin Nutr ESPEN. 2022;49:295–300. https://doi.org/10.1016/j.clne....
43.
Hammad H, Lambrecht BN. The basic immunology of asthma. Cell. 2021;184(6):1469–1485. https://doi.org/10.1016/j.cell....
44.
Oppenheimer J, Hoyte FCL, Phipatanakul W, et al. Allergic and eosinophilic asthma in the era of biomarkers and biologics: similarities, differences and misconceptions. Ann Allergy Asthma Immunol. 2022; 129(2): 169–180. https://doi.org/10.1016/j.anai....
45.
Matheu V, Bäck O, Mondoc E, et al. Dual effects of vitamin D-induced alteration of TH1/TH2 cytokine expression: enhancing IgE production and decreasing airway eosinophilia in murine allergic airway disease. J Allergy Clin Immunol. 2003;112(3):585–592. https://doi.org/10.1016/s0091-....
46.
Cho SW, Kim JH, Choi JH, et al. Preventive and therapeutic effects of vitamin D in a mouse model of allergic asthma. Asian Pacific J allergy Immunol. 2019;37(3):130–137. https://doi.org/10.12932/AP-01....
47.
Agrawal T, Gupta GK, Agrawal DK. Vitamin D supplementation reduces airway hyperresponsiveness and allergic airway inflammation in a murine model. Clin Exp Allergy. 2013;43(6):672–683. https://doi.org/10.1111/cea.12....
48.
Taher YA, van Esch BCAM, Hofman GA, et al. 1alpha,25-dihydroxyvitamin D3 potentiates the beneficial effects of allergen immunotherapy in a mouse model of allergic asthma: role for IL-10 and TGF-beta. J Immunol. 2008;180(8):5211–5221. https://doi.org/10.4049/jimmun....
49.
Ramos-Martínez E, López-Vancell MR, Fernández de Córdova-Aguirre JC, et al. Reduction of respiratory infections in asthma patients supplemented with vitamin D is related to increased serum IL-10 and IFNγ levels and cathelicidin expression. Cytokine. 2018;108:239–246. https://doi.org/10.1016/j.cyto....
50.
Bar Yoseph R, Livnat G, Schnapp Z, et al. The effect of vitamin D on airway reactivity and inflammation in asthmatic children: A double-blind placebo-controlled trial. Pediatr Pulmonol. 2015;50(8):747–753. https://doi.org/10.1002/ppul.2....
51.
Spagnolo P, Rossi G, Cavazza A, et al. Hypersensitivity Pneumonitis: A Comprehensive Review. J Investig Allergol Clin Immunol. 2015;25(4):237–250.
52.
Vasakova M, Selman M, Morell F, et al. Hypersensitivity Pneumonitis: Current Concepts of Pathogenesis and Potential Targets for Treatment. Am J Respir Crit Care Med. 2019;200(3):301–308. https://doi.org/10.1164/rccm.2....
53.
Nogueira R, Melo N, Novais E Bastos H, et al. Hypersensitivity pneumonitis: Antigen diversity and disease implications. Pulmonology. 2019;25(2):97–108. https://doi.org/10.1016/j.pulm....
54.
Churg A. Hypersensitivity pneumonitis: new concepts and classifications. Mod Pathol. 2022;35(Suppl 1):15–27. https://doi.org/10.1038/s41379....
55.
Barnes H, Troy L, Lee CT, et al. Hypersensitivity pneumonitis: Current concepts in pathogenesis, diagnosis, and treatment. Allergy. 2022;77(2):442–453. https://doi.org/10.1111/all.15....
56.
Lemieszek MK, Chojnacki M, Paśnik I, et al. Beneficial Impact of Inhaled 25(OH)-Vitamin D3 and 1,25(OH)2-Vitamin D3 on Pulmonary Response in the Murine Model of Hypersensitivity Pneumonitis. Int J Mol Sci. 2024;25(19):10289. https://doi.org/10.3390/ijms25....
Udostępnij
ARTYKUŁ POWIĄZANY
Przetwarzamy dane osobowe zbierane podczas odwiedzania serwisu. Realizacja funkcji pozyskiwania informacji o użytkownikach i ich zachowaniu odbywa się poprzez dobrowolnie wprowadzone w formularzach informacje oraz zapisywanie w urządzeniach końcowych plików cookies (tzw. ciasteczka). Dane, w tym pliki cookies, wykorzystywane są w celu realizacji usług, zapewnienia wygodnego korzystania ze strony oraz w celu monitorowania ruchu zgodnie z Polityką prywatności. Dane są także zbierane i przetwarzane przez narzędzie Google Analytics (więcej).
Możesz zmienić ustawienia cookies w swojej przeglądarce. Ograniczenie stosowania plików cookies w konfiguracji przeglądarki może wpłynąć na niektóre funkcjonalności dostępne na stronie.
Możesz zmienić ustawienia cookies w swojej przeglądarce. Ograniczenie stosowania plików cookies w konfiguracji przeglądarki może wpłynąć na niektóre funkcjonalności dostępne na stronie.