Online first
Bieżący numer
Archiwum
O czasopiśmie
Polityka etyki publikacyjnej
System antyplagiatowy
Instrukcje dla Autorów
Instrukcje dla Recenzentów
Rada Redakcyjna
Komitet Redakcyjny
Recenzenci
Wszyscy recenzenci
2024
2023
2022
2021
2020
2019
2018
2017
2016
Kontakt
Bazy indeksacyjne
Klauzula przetwarzania danych osobowych (RODO)
PRACA PRZEGLĄDOWA
Możliwość wykorzystania witaminy D3 w prewencji włóknienia płuc poprzez hamowanie zjawiska EMT: przegląd
wyników badań in vitro, in vivo oraz z udziałem pacjentów
1
Zakład Biologii Medycznej, Instytut Medycyny Wsi w Lublinie, Polska
Autor do korespondencji
Marta Kinga Lemieszek
Zakład Biologii Medycznej, Instytut Medycyny Wsi w Lublinie, Jaczewskiego 2, 20-090, Lublin, Polska
Zakład Biologii Medycznej, Instytut Medycyny Wsi w Lublinie, Jaczewskiego 2, 20-090, Lublin, Polska
Med Og Nauk Zdr. 2025;31(1):20-27
SŁOWA KLUCZOWE
DZIEDZINY
STRESZCZENIE
Wprowadzenie i cel:
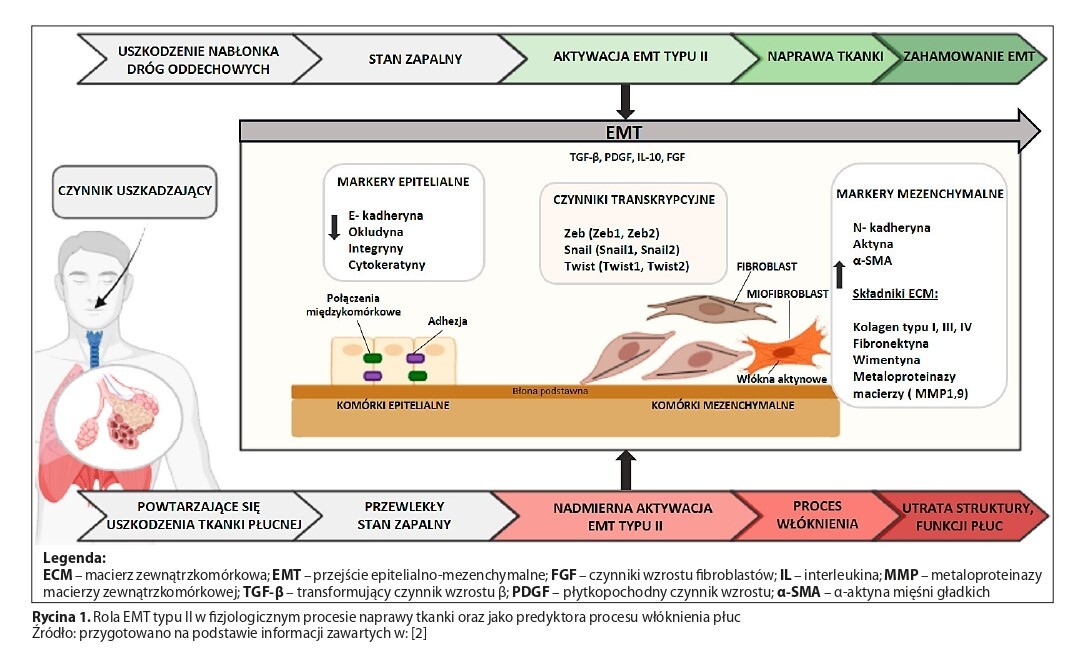
Przejście epitelialno-mezenchymalne (EMT) prowadzące do przekształcenia komórek nabłonkowych w mezenchymalne, odgrywa istotną rolę w naprawie i regeneracji tkanek. O ile w warunkach fizjologicznych wygaśnięcie zapalenia powoduje zatrzymanie EMT, o tyle przewlekły stan zapalny napędza ten proces, prowadząc do włóknienia. Z uwagi na kluczową rolę EMT w patologicznej przebudowie tkanek słuszne wydaje się ukierunkowanie terapii zwłóknień na hamowaniu tego zjawiska. Użyteczna w tym zakresie może być witamina D3. Celem niniejszej pracy było przedstawienie możliwości wykorzystania witaminy D3 w prewencji włóknień płuc.
Metody przeglądu:
W artykule przedstawiono aktualny stan wiedzy na temat wpływu witaminy D3 na zjawisko EMT w wybranych chorobach płuc, tj. IPF, POChP, AZPP, astmie alergicznej. Analizie poddano prace oryginalne dostępne w bazach PubMed i Google Scholar.
Opis stanu wiedzy:
Wyniki badań in vitro, in vivo, a także z udziałem pacjentów jednoznacznie wykazały, że witamina D3, a zwłaszcza jej aktywna biologiczne forma, tj. kalcytriol, skutecznie hamuje proces EMT typu II, leżący u podłoża włóknienia płuc. Korzystne działanie witaminy D3 obejmowało: zwiększenie ekspresji receptora VDR; obniżenie ekspresji czynników inicjujących EMT; wyciszenie przekazywania sygnałów w szlakach związanych z TGF-β; obniżenie ekspresji czynników transkrypcyjnych nadzorujących EMT; utrzymanie fenotypu nabłonkowego poprzez modulację ekspresji markerów epitelialnych oraz mezenchymalnych związanych z EMT
Podsumowanie:
Zaprezentowany hamujący wpływ witaminy D3 na zjawisko EMT sugeruje, że przywrócenie fizjologicznego stężenia tego metabolitu u pacjentów z IPF, POChP, AZPP oraz astmą alergiczną może stanowić istotny element prewencji włóknienia płuc oraz patologicznej przebudowy tkanek.
Przejście epitelialno-mezenchymalne (EMT) prowadzące do przekształcenia komórek nabłonkowych w mezenchymalne, odgrywa istotną rolę w naprawie i regeneracji tkanek. O ile w warunkach fizjologicznych wygaśnięcie zapalenia powoduje zatrzymanie EMT, o tyle przewlekły stan zapalny napędza ten proces, prowadząc do włóknienia. Z uwagi na kluczową rolę EMT w patologicznej przebudowie tkanek słuszne wydaje się ukierunkowanie terapii zwłóknień na hamowaniu tego zjawiska. Użyteczna w tym zakresie może być witamina D3. Celem niniejszej pracy było przedstawienie możliwości wykorzystania witaminy D3 w prewencji włóknień płuc.
Metody przeglądu:
W artykule przedstawiono aktualny stan wiedzy na temat wpływu witaminy D3 na zjawisko EMT w wybranych chorobach płuc, tj. IPF, POChP, AZPP, astmie alergicznej. Analizie poddano prace oryginalne dostępne w bazach PubMed i Google Scholar.
Opis stanu wiedzy:
Wyniki badań in vitro, in vivo, a także z udziałem pacjentów jednoznacznie wykazały, że witamina D3, a zwłaszcza jej aktywna biologiczne forma, tj. kalcytriol, skutecznie hamuje proces EMT typu II, leżący u podłoża włóknienia płuc. Korzystne działanie witaminy D3 obejmowało: zwiększenie ekspresji receptora VDR; obniżenie ekspresji czynników inicjujących EMT; wyciszenie przekazywania sygnałów w szlakach związanych z TGF-β; obniżenie ekspresji czynników transkrypcyjnych nadzorujących EMT; utrzymanie fenotypu nabłonkowego poprzez modulację ekspresji markerów epitelialnych oraz mezenchymalnych związanych z EMT
Podsumowanie:
Zaprezentowany hamujący wpływ witaminy D3 na zjawisko EMT sugeruje, że przywrócenie fizjologicznego stężenia tego metabolitu u pacjentów z IPF, POChP, AZPP oraz astmą alergiczną może stanowić istotny element prewencji włóknienia płuc oraz patologicznej przebudowy tkanek.
Introduction and objective:
Epithelial-mesenchymal transition (EMT), which transforms epithelial cells into mesenchymal cells, plays an important role in tissue repair and regeneration. While in physiological conditions the cessation of inflammation causes the suppression of EMT, chronic inflammation drives this process, ultimately leading to fibrosis. Due to the key role of EMT in pathological tissue remodelling, it seems reasonable to focus fibrosis therapy on inhibiting this phenomenon. Vitamin D3 may be useful in this field. The aim of this study was to present the possibilities of using vitamin D3 to prevent lung fibrosis.
Review methods:
The article presents the current state of knowledge on the effect of vitamin D3 on the EMT phenomenon in selected lung diseases, i.e. IPF, COPD, AZPP, and allergic asthma. Original articles available in the PubMed and Google Scholar databases were analyzed. Brief description of the state of knowledge The results of in vitro, in vivo, and clinical studies revealed that vitamin D3, and especially its biologically active form, i.e. calcitriol, effectively inhibits the EMT type II underlying lung fibrosis. The beneficial effects of vitamin D3 included: increased expression of the VDR receptor; decreased expression of EMT initiating factors; silencing of signals transduction in TGF-β-related pathways; down-regulation of transcription factors supervising EMT; maintenance of the epithelial phenotype by modulating the expression of epithelial and mesenchymal markers associated with EMT.
Summary:
The presented inhibitory effect of vitamin D3 on the EMT phenomenon suggests that restoration of the physiological level of this metabolite in patients with IPF, COPD, AZPP, and allergic asthma may be an important element in the prevention of lung fibrosis and pathological tissue remodelling.
Epithelial-mesenchymal transition (EMT), which transforms epithelial cells into mesenchymal cells, plays an important role in tissue repair and regeneration. While in physiological conditions the cessation of inflammation causes the suppression of EMT, chronic inflammation drives this process, ultimately leading to fibrosis. Due to the key role of EMT in pathological tissue remodelling, it seems reasonable to focus fibrosis therapy on inhibiting this phenomenon. Vitamin D3 may be useful in this field. The aim of this study was to present the possibilities of using vitamin D3 to prevent lung fibrosis.
Review methods:
The article presents the current state of knowledge on the effect of vitamin D3 on the EMT phenomenon in selected lung diseases, i.e. IPF, COPD, AZPP, and allergic asthma. Original articles available in the PubMed and Google Scholar databases were analyzed. Brief description of the state of knowledge The results of in vitro, in vivo, and clinical studies revealed that vitamin D3, and especially its biologically active form, i.e. calcitriol, effectively inhibits the EMT type II underlying lung fibrosis. The beneficial effects of vitamin D3 included: increased expression of the VDR receptor; decreased expression of EMT initiating factors; silencing of signals transduction in TGF-β-related pathways; down-regulation of transcription factors supervising EMT; maintenance of the epithelial phenotype by modulating the expression of epithelial and mesenchymal markers associated with EMT.
Summary:
The presented inhibitory effect of vitamin D3 on the EMT phenomenon suggests that restoration of the physiological level of this metabolite in patients with IPF, COPD, AZPP, and allergic asthma may be an important element in the prevention of lung fibrosis and pathological tissue remodelling.
Gawryś W, Lemieszek MK. Możliwość wykorzystania witaminy D3 w prewencji włóknienia płuc poprzez hamowanie zjawiska EMT: przegląd
wyników badań in vitro, in vivo oraz z udziałem pacjentów. Med Og Nauk Zdr. 2025; 31(1): 20–27. doi: 10.26444/monz/200682
REFERENCJE (41)
1.
Larriba M J, García de Herreros A, Muñoz A. Vitamin D and the epithelial to mesenchymal transition. Stem cells int. 2016;2016(1):6213872. https://doi.org/10.1155/2016/6....
2.
Marconi GD, Fonticoli L, Rajan TS, et al. Epithelial-mesenchymal transition (EMT): the type-2 EMT in wound healing, tissue regeneration and organ fibrosis. Cells. 2021;10(7):1587. https://doi.org/10.3390/cells1....
3.
Gaudet M, Plesa M, Mogas A, et al. Recent advances in vitamin D implications in chronic respiratory diseases. Respir Res. 2021;23(1):252. https://doi.org/10.1186/s12931....
4.
Chojnacki M, Lemieszek MK. Role of vitamin D3 in selected pulmonary diseases with particular emphasis on lung fibrosis. Ann Agr Env Med. 2023;30(1):31–44. https://doi.org/10.26444/aaem/....
5.
Ma D, Peng L. Vitamin D and pulmonary fibrosis: a review of molecular mechanisms. Int J Clin Exp Pathol. 2019;12(9):3171.
6.
Monti N, Cucina A. Fibrosis: A Role for Vitamin D. Org J Biol Sci. 2020;4(1):26–41. https://doi.org/10.13133/2532-....
7.
He H, Ji X, Cao L, et al. Medicine Targeting Epithelial-Mesenchymal Transition to Treat Airway Remodeling and Pulmonary Fibrosis Progression. Can Respir J. 2023;2023(1):3291957. https://doi.org/10.1155/2023/3....
8.
Salton F, Volpe MC, Confalonieri M. Epithelial–Mesenchymal Transition in the Pathogenesis of Idiopathic Pulmonary Fibrosis. Medicina. 2019;55:83. https://doi.org/10.3390/medici....
9.
Hill C, Jones M G, Davies D E, et al. Epithelial-mesenchymal transition contributes to pulmonary fibrosis via aberrant epithelial/fibroblastic cross-talk. J lung health dis. 2019;3(2):31. https://doi.org/10.29245/2689-....
10.
Gayan Ramirez G, Janssens W. Vitamin D actions: the lung is a major target for vitamin D, FGF23, and Klotho. JBMR Plus. 2021;5(12):e10569. https://doi.org/10.1002/jbm4.1....
11.
Olmos-Ortiz A, Avila E, Durand-Carbajal M, et al. Regulation of Calcitriol Biosynthesis and Activity: Focus on Gestational Vitamin D Deficiency and Adverse Pregnancy Outcomes. Nutrients. 2015;7(1):443–480. https://doi.org/10.3390/nu7010....
12.
Tzilas V, Bouros E, Barbayianni I, et al. Vitamin D prevents experimental lung fibrosis and predicts survival in patients with idiopathic pulmonary fibrosis. Pulm Pharmacol Ther. 2019;55:17–24. https://doi.org/10.1016/j.pupt....
13.
Lehouck A, Mathieu C, Carremans C, et al. High doses of vitamin D to reduce exacerbations in chronic obstructive pulmonary disease: a randomized trial. Ann Intern Med. 2012;156(2):105–114. https://doi.org/10.7326/0003-4....
14.
Yang L, Zhai Z, Zhang J. The role of serum 1, 25-Dihydroxy vitamin D3 and PCT in idiopathic pulmonary fibrosis. Int J Gen Med. 2022;15:8081. https://doi.org/10.2147/IJGM.S....
15.
Fu L, Fei J, Tan Z, et al. Low vitamin D status is associated with inflammation in patients with chronic obstructive pulmonary disease. J Immunol. 2021;206(3):515–523. https://doi.org/10.4049/jimmun....
16.
Ramirez A M, Wongtrakool C, Welch T, et al. Vitamin D inhibition of pro-fibrotic effects of transforming growth factor β1 in lung fibroblasts and epithelial cells. J Steroid Biochem Mol Biol. 2010;118(3):142–150. https://doi.org/10.1016/j.jsbm....
17.
Zheng S, Yang J, Hu X, et al.Vitamin D attenuates lung injury via stimulating epithelial repair, reducing epithelial cell apoptosis and inhibits TGF-β induced epithelial to mesenchymal transition. Biochem pharmacol. 2020;177:113955. https://doi.org/10.1016/j.bcp.....
18.
Li SR, Tan ZX, Chen YH, et al. Vitamin D deficiency exacerbates bleomycin-induced pulmonary fibrosis partially through aggravating TGF-β/Smad2/3-mediated epithelial-mesenchymal transition. Respir res. 2019;20:1–11. https://doi.org/10.1186/s12931....
19.
Fei J, Fu L, Cao W, et al. Low vitamin D status is associated with epithelial– Mesenchymal transition in patients with chronic obstructive pulmonary disease. J Immunol. 2019;203(6):1428–1435. https://doi.org/10.4049/jimmun....
20.
Sari E, Oztay F, Tasci AE. Vitamin D modulates E-cadherin turnover by regulating TGF-β and Wnt signalings during EMT-mediated myofibroblast differentiation in A459 cells. J Steroid Biochem Mol Biol. 2020;202:105723. https://doi.org/10.1016j.jsbmb....
21.
Fischer KD. Analysis of immunomodulatory effects of vitamin D in epithelial-mesenchymal transition and airway remodeling in allergic airway inflammation. Creighton University; 2015.
22.
Chang J, Nie H, Ge X, et al. Vitamin D suppresses bleomycin-induced pulmonary fibrosis by targeting the local renin–angiotensin system in the lung. Sci Rep. 2021;11(1):16525. https://doi.org/10.1038/s41598....
23.
Saito A, Horie M, Nagase T. TGF-β signaling in lung health and disease. Int J Mol Sci. 2018;19(8):2460. https://doi.org/10.3390/ijms19....
24.
Zhu W, Ding Q, Wang L, et al. Vitamin D3 alleviates pulmonary fibrosis by regulating the MAPK pathway via targeting PSAT1 expression in vivo and in vitro. Int Immunopharmacol. 2021;101:108212. https://doi.org/10.1016/j.inti....
25.
Jiang F, Yang Y, Xue L, et al. 1α, 25-dihydroxyvitamin D3 attenuates. TGF-β-induced pro-fibrotic effects in human lung epithelial cells through inhibition of epithelial–mesenchymal transition. Nutrients. 2017; 9(9):980. https://doi.org/10.3390/nu9090....
26.
Fischer KD, Agrawal DK. Vitamin D regulating TGF-β induced epithelial-mesenchymal transition. Respir Res. 2014;15:1–13. http://dx.doi.org/10.1186/s129....
27.
Lemieszek MK, Rzeski W, Golec M, et al. Pantoea agglomerans chronic exposure induces epithelial-mesenchymal transition in human lung epithelial cells and mice lungs. Ecotoxicol Environ Saf. 2020;194:110416. https://doi.org/10.1016/j.ecoe....
28.
Tan ZX, Chen YH, Xu S, et al. Calcitriol inhibits bleomycin-induced early pulmonary inflammatory response and epithelial–mesenchymal transition in mice. Toxicol Lett. 2016;240(1):161–171. https://doi.org/10.1016/j.toxl....
29.
Lemieszek MK, Chojnacki M, Paśnik I, et al. Beneficial Impact of Inhaled 25 (OH)-Vitamin D3 and 1, 25 (OH) 2-Vitamin D3 on Pulmonary Response in the Murine Model of Hypersensitivity Pneumonitis. Int J Mol Sci. 2024;25(19):10289. https://doi.org/10.3390/ijms25....
30.
Ye Z, Hu Y.TGF β1: Gentlemanly orchestrator in idiopathic pulmonary fibrosis. Int J Mol Med. 2021;48(1):1–14. https://doi.org/10.3892/ijmm.2....
31.
Kreuter M, Lederer DJ, Molina-Molina M, et al. Association of angiotensin modulators with the course of idiopathic pulmonary fibrosis. Chest. 2019;156(4):706–714. https://doi.org/10.1016/j.ches....
32.
Shi Y, Liu T, Yao LI, et al. Chronic vitamin D deficiency induces lung fibrosis through activation of the renin-angiotensin system. Sci Rep. 2017;7(1):3312. https://doi.org/10.1038/s41598....
33.
Cao H, Wang C, Chen X, et al. Inhibition of Wnt/β-catenin signaling suppresses myofibroblast differentiation of lung resident mesenchymal stem cells and pulmonary fibrosis. Sci Rep. 2018;8(1):13644. https://doi.org/10.1038s41598-....
34.
Liu J, Xiao Q, Xiao J, et al. Wnt/β-catenin signalling: function, biological mechanisms, and therapeutic opportunities. Signal transduct target ther. 2022;7(1):3. https://doi.org/10.1038/s41392....
35.
Chen X, Shi C, Meng X, et al. Inhibition of Wnt/β-catenin signaling suppresses bleomycin-induced pulmonary fibrosis by attenuating the expression of TGF-β1 and FGF-2. Exp Mol Pathol. 2016;101(1):22–30. https://doi.org/10.1016/j.yexm....
36.
Shi J, Li F, Luo M, et al. Distinct roles of Wnt/β-catenin signaling in the pathogenesis of chronic obstructive pulmonary disease and idiopathic pulmonary fibrosis. Mediators inflamm. 2017;2017(1):3520581. https://doi.org/10.1155/2017/3....
37.
Fang Y, Tian J, Fan Y, et al. Latest progress on the molecular mechanisms of idiopathic pulmonary fibrosis. Mol Biol Rep. 2020;47(12):9811–9820. https://doi.org/10.1007/s11033....
38.
Xiong XR, Tian XL, Huo RJ, et al. 1α, 25-dihydroxyvitamin D3 inhibits transforming growth factor β1-induced epithelial-mesenchymal transition via β-catenin pathway. Chin Med J. 2020;133(11):1298–1303. https://doi.org/10.1097/CM9.00....
39.
Huang Y, Wang L, Jia XX, et al. Vitamin D alleviates airway remodeling in asthma by down-regulating the activity of Wnt/β-catenin signaling pathway. Int Immunopharmacol. 2019;68:88–94. https://doi.org/10.1016j.intim....
40.
Pieniążek M, Donizy P, Ziętek M, et al. Rola szlaków sygnalizacyjnych związanych z TGF-β w patogenezie przejścia nabłonkowo-mezenchymalnego (EMT) jako głównego elementu warunkującego progresję choroby nowotworowej. Postepy Hig Med Dosw (online). 2012;66:583–591.
41.
Sobczak M, Pawliczak R. Does vitamin D work synergistically with anti- -asthmatic drugs in airway remodeling? Int J Mol Sci. 2022;23(21):12798. https://doi.org/10.3390/ijms23....
Udostępnij
ARTYKUŁ POWIĄZANY
Przetwarzamy dane osobowe zbierane podczas odwiedzania serwisu. Realizacja funkcji pozyskiwania informacji o użytkownikach i ich zachowaniu odbywa się poprzez dobrowolnie wprowadzone w formularzach informacje oraz zapisywanie w urządzeniach końcowych plików cookies (tzw. ciasteczka). Dane, w tym pliki cookies, wykorzystywane są w celu realizacji usług, zapewnienia wygodnego korzystania ze strony oraz w celu monitorowania ruchu zgodnie z Polityką prywatności. Dane są także zbierane i przetwarzane przez narzędzie Google Analytics (więcej).
Możesz zmienić ustawienia cookies w swojej przeglądarce. Ograniczenie stosowania plików cookies w konfiguracji przeglądarki może wpłynąć na niektóre funkcjonalności dostępne na stronie.
Możesz zmienić ustawienia cookies w swojej przeglądarce. Ograniczenie stosowania plików cookies w konfiguracji przeglądarki może wpłynąć na niektóre funkcjonalności dostępne na stronie.